Une même protéine toxique pour le cerveau, mais deux maladies. Une équipe franco-belge vient de démontrer que la maladie de Parkinson et l’atrophie multi-systématisée (AMS), deux maladies neurodégénératives, ont la même cause biologique. Une seule caractéristique les sépare, expliquent les chercheurs dans la revue Nature : la forme sous laquelle la protéine alpha-synucléine s’agrège.
Deux formes, deux maladies
L’alpha-synucléine est une protéine à la fonction encore mal identifiée, mais nécessaire pour que les neurones communiquent entre eux. Lorsque sa forme est fonctionnelle, elle ne présente pas de danger pour le cerveau. Mais il existe des formes dites non-fonctionnelles qui peuvent être toxiques et qui ont la capacité de s’agréger de manière infinie. « C’est une réaction irréversible qui finit par recruter toutes les protéines similaires de la cellule, explique à Pourquoidocteur Ronald Melki, directeur de recherche au CNRS et co-auteur de l’étude. Cela perturbe la membrane du neurone, qui est très importante, car elle permet à l’influx nerveux de passer. »
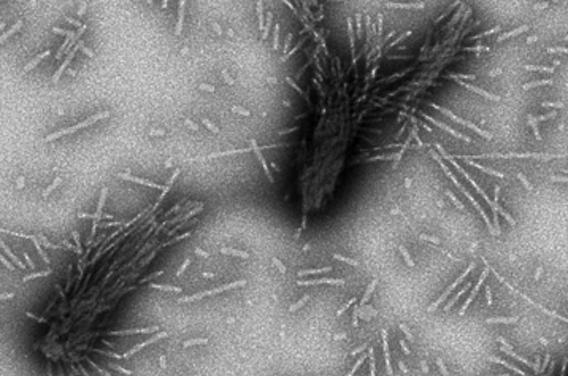
L’équipe de l’Institut des Neurosciences de Saclay (Essonne), dirigée par Ronald Meki, a isolé différents types d’agrégats d’alpha-synucléine. Les chercheurs ont donc supposé que, selon l’assemblage, la maladie induite n’était pas la même.
Pour illustrer la découverte, le directeur de recherche utilise des pâtes, « sans doute parce que je suis gourmand », plaisante-t-il. Certains agrégats ressemblent donc à des linguines, des pâtes longues et larges, d’autres à des spaghettis, cylindriques et pleins.
« On a donc préparé ces agrégats, et on les a injectés dans le cerveau de rats, raconte Ronald Melki. Ces rongeurs ont développé différentes maladies, selon le type d'agrégats qu’on leur avait injectés. » Voilà qui permet de mieux comprendre la genèse de la maladie.
Tout savoir sur la maladie de Parkinson
Comment la forme des agrégats est-elle définie ?
« Dans un tube à essai, des petites variations dans les conditions d’agrégation vont définir la forme de ces amas », résume Ronald Melki. Selon la concentration en sel, la température, cela changera. « Ces paramètres ne sont pas totalement artificiels, souligne ce chercheur. Le neurone au niveau de l’intestin n’a pas la même température qu’un neurone situé dans le cerveau. La cellule a aussi des compartiments dont certains sont acides, ajoute-t-il. Le lysosome, par exemple, est un endroit où se dégradent les protéines qui ne sont plus fonctionnelles. Il a un pH légèrement acide. »
Un diagnostic par prise de sang
Après avoir injecté avec succès les agrégats dans le cerveau des rats, les chercheurs ont tenté un autre mode d’administration : par le sang. « L’objectif n’est pas de montrer que ces maladies sont infectieuses, mais de montrer que les agrégats passent d’une cellule à l’autre », souligne Ronald Melki. Les chercheurs ont montré que, lorsqu’elles sont injectées dans le sang, les protéines anormales parviennent jusqu’au cerveau.
Une observation qui contredit l’idée selon laquelle le cerveau est isolé du reste du système circulatoire. « Mais il faut lire cela dans l’autre sens, avertit le directeur de recherche. Les agrégats qui se forment dans le cerveau peuvent se diffuser dans le sang. » Il serait donc envisageable, si l’on en croit ces résultats, de détecter la maladie de Parkinson avant même l’apparition des symptômes, grâce à une prise de sang. « C’est faisable, il faut maintenant créer l’outil pour, mais il nous faudra un peu de temps », reconnaît Ronald Melki.
Mais ce chercheur est rempli d’espoir. Ces résultats lui font imaginer un nouveau mode de traitement : attirer les agrégats hors du cerveau, les y piéger afin d’interrompre l’évolution de la maladie. Il n’hésite pas à comparer ses travaux avec ceux menés il y a un siècle en bactériologie : « A l'époque, on ne comprenait pas comment fonctionnaient les bactéries. Aujourd’hui, on le comprend et on crée des antibiotiques. Cette compréhension va aboutir à des propositions de médicaments », postule-t-il.