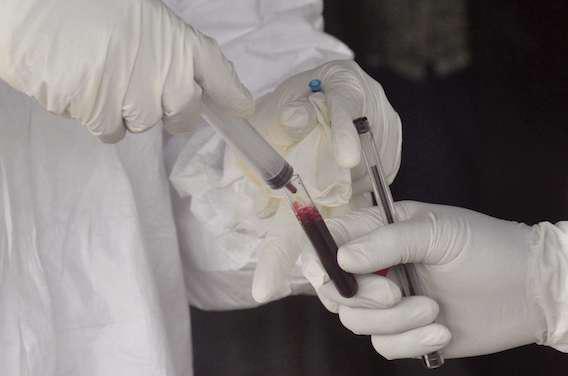
« C’est une avancée prometteuse », selon les mots de Margaret Chan, Directeur général de l’Organisation mondiale de la Santé (OMS). Depuis début avril 2015, un essai clinique de phase III évalue un candidat-vaccin contre le virus Ebola. Ce 31 juillet, les résultats préliminaires sont publiés dans The Lancet. En plus de protéger les individus vaccinés à 100 % contre la fièvre hémorragique virale, VSV-EBOV pourrait bien établir une protection collective.
Accès élargi aux mineurs
L’essai clinique Ebola ça suffit a été mené en Basse-Guinée. A chaque diagnostic d’Ebola, les contacts proches ont été retrouvés. Les chercheurs ont alors proposé aux personnes éligibles (plus de 18 ans, hors grossesse et allaitement) d’être vaccinées. Au total, 7 651 personnes ont accepté. Protéger les proches, c’est ce qu’on appelle la vaccination en ceinture.
« La méthode de vaccination dite ‘en ceinture’ adoptée pour l’essai est basée sur la stratégie d’éradication de la variole, explique John-Arne Røttingen, président du Groupe de pilotage de l’étude. Notre hypothèse de base est qu’en vaccinant toutes les personnes qui ont été en contact avec un sujet infecté, on crée une ‘ceinture’ de protection qui permet d’enrayer la propagation du virus. »
Sur les 90 groupes à risque identifiés, 48 ont été vaccinés immédiatement, 42 après un délai de trois semaines. L’objectif était de vérifier l’efficacité de l’immunisation. Depuis le 26 juillet, sur avis du Comité indépendant, toute personne à risque peut recevoir le produit dès son inclusion dans l’essai clinique. Il devrait aussi être élargi aux mineurs de plus de 12 ans.
Un vaccin bien toléré
Une seule injection intramusculaire, dans le bras, fournit une protection totale (100 %) contre la fièvre hémorragique à virus Ebola. « Avant le début de l’essai, dans la plupart des groupes, il y a eu une série de cas dans les semaines précédant la répartition aléatoire, reconnaît le Dr Marie-Paule Kieny, sous-directeur général de l’OMS en charge de diriger les efforts de recherche et développement contre Ebola. Mais depuis le début de l’essai, nous n’avons vu aucun cas parmi les volontaires vaccinés dans les 10 jours suivant la vaccination, qu’elle ait été retardée ou non. »
Les analyses secondaires font aussi état d’une protection élargie. Les personnes non-vaccinées des 90 groupes étaient 76 % moins à risque d’être testées positives. La protection collective doit encore être démontrée, tout comme l’innocuité du produit. Mais le vaccin est bien toléré : un seul patient a fait une poussée de fièvre suivant l’injection.
Un autre essai est mené en parallèle sur les intervenants en première ligne. Si l’enthousiasme est de mise, les éditeurs du Lancet appellent cependant à la prudence : « Le vaccin n’est pas encore agréé. Plus de données sur son efficacité sont nécessaires avant qu’il soit utilisé largement. Mais si les preuves sont suffisantes pour son agrément, une équipe de mise en place mondiale du vaccin contre Ebola, également sous le patronage de l’OMS, a préparé le terrain pour son introduction. En outre, GAVI Alliance a approuvé un financement substantiel pour se procurer et pour déployer le vaccin. »