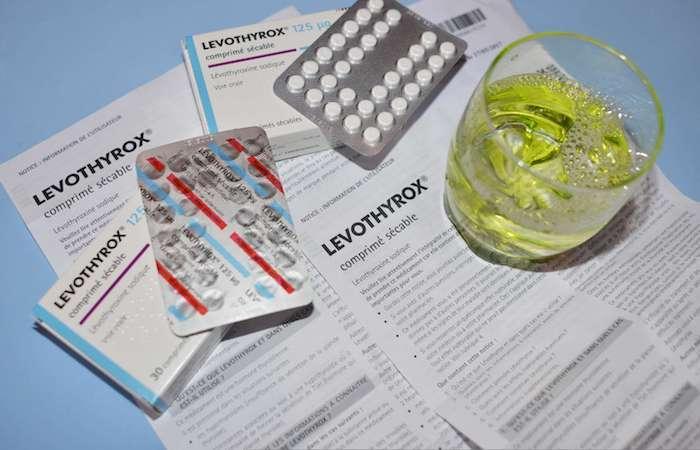
Le changement de formule du Levothyrox se fait dans la difficulté en France. Des milliers de patients se plaignent d’effets secondaires liés à la nouvelle formule de ce traitement contre les troubles de la thyroïde. Les autorités sanitaires se veulent rassurantes : ces effets s’estomperont, ils sont liés au profil du médicament dont le dosage doit être millimétré et dont les variations peuvent engendrer ces effets indésirables.
Il n’empêche. Une plainte contre X a été déposée, une pétition réclame le retour à l’ancienne formule, modifiée par le laboratoire sur demande de l’ANSM (agence nationale de sécurité du médicament), afin d’améliorer la stabilité du médicament. Les regards se tournent vers le laboratoire, accusé de ne pas avoir suffisamment prévenu, anticipé, informé. En Belgique, par exemple, les tests liés à la nouvelle formule ont été menés sur des volontaires malades. Ils ont permis de recenser l’ensemble des effets secondaires et les profils de patients concernés. Pourquoi la France n’a-t-elle pas suivi ce chemin ? Valérie Léto, pharmacienne responsable Merck, revient sur ces questions.
Vous attendiez-vous à une augmentation d’effets indésirables liés à la nouvelle formule ?
Valérie Léto : Oui, mais pas dans cette mesure. Nous avions identifié une population particulière de patients, qui risquaient de rencontrer des effets secondaires avec le passage à la nouvelle formule. Il s’agit des patients qui ont déjà eu des difficultés à obtenir un équilibre thyroïdien. Nous avons informé les prescripteurs et les pharmaciens du changement de formule, en précisant que pour certains patients, il sera important d’effectuer des dosages TSH afin de vérifier qu’ils ne sont pas en hypothyroïdie ou hyperthyroïdie.
Mais nous ne nous attendions pas à avoir autant de remontées. Il y a peut-être un effet médiatique. Toutefois, les déclarations d’effets indésirables que nous recueillons se réfèrent à des symptômes attendus, en lien avec un déséquilibre thyroïdien. Aucun effet secondaire décrit ne sort de ce cadre. D’ailleurs, des essais ont été menés par notre laboratoire, ils valident la conformité du médicament. Le produit que nous avons mis sur le marché est un produit de qualité. Une autre étude menée par l’ANSM est en cours sur les comprimés afin d’en vérifier la qualité et de comparer les résultats avec les nôtres.
Pourquoi ne pas avoir tenté d’évaluer ces effets indésirables en amont, sachant qu’ils surviendraient ?
Valérie Léto : Nous avons mené, sous demande de l’ANSM, deux types d’analyses : des essais de stabilité du médicament (en accéléré pendant six mois à 40 degrés, et en conditions réelles pendant deux ans), et des essais de bioéquivalence. L’agence n’a pas exigé d’analyses supplémentaires, car ce n’est pas la procédure lors du changement d’excipients.
Nous ne pensons pas que des essais menés sur des volontaires malades auraient permis de mieux évaluer les effets secondaires. Nous aurions probablement vu des signes d’hypothyroïdie et d’hyperthyroïdie, mais ces résultats auraient été difficiles à interpréter, puisqu’il y a une forte variabilité d’un individu à l'autre… En général, on ne mène pas d’études sur des malades après la commercialisation d’un médicament, en tout cas, on ne nous l’a pas demandé. Je sais que cela a été fait en Belgique par Takeda, mais le laboratoire a entrepris ce type d’essai, car les études de bioéquivalence qu’il avait d’abord menées ne permettaient pas de démontrer l’équivalence entre les deux formules.
Pourquoi ne pas avoir informé les patients par le biais de la notice qu’ils pouvaient subir des effets indésirables ?
Valérie Léto : Lorsque nous avons lancé le produit, l’analyse que nous en avons fait, c’est qu’il fallait passer par les professionnels de santé pour diffuser l’information et non directement par les patients. Cette décision était motivée par le fait que ce n’est pas au patient de modifier son dosage, mais au professionnel de santé d’en décider, d’analyser les symptômes qui ne sont peut-être pas dus au Levothyrox. L’important était donc que le médecin et le pharmacien aient l’information pour regarder la pathologie dans son ensemble. Nous avons par ailleurs modifié le design des boîtes afin qu’il n’y ait pas de confusion.
La ministre a annoncé la création d’un groupe de travail pour voir ce qu’il s’est passé et ce qui aurait été mieux de faire, afin de tirer les leçons. Nous y participerons, bien entendu, si nous sommes sollicités. Nous analysons également en interne la communication et la gestion autour du changement de formule. Est-ce qu’une communication proactive dans les boîtes, comme en Belgique, aurait pu mieux répondre aux besoin des patients ? C’est une analyse que nous sommes en train de mener.
La procédure européenne est-elle compromise par les problèmes rencontrés en France ?
Valérie Léto : Une procédure d’harmonisation a en effet été lancée auprès de l’EMA (Agence Européenne du Médicament) afin que la nouvelle formule soit disponible dans les autres pays européens, où l’on trouve l’ancienne formule. La demande est en cours et je n’ai pas d’information concernant un éventuel frein à la procédure. La situation est assez différente dans les autres pays d’Europe car eux disposent d’alternatives au Levothyrox.