Tout était prêt. La ministre de la Santé avait même fait voter dans le cadre de la loi de financement de la sécurité sociale pour 2013 une disposition explicitement dédiée à résoudre le problème Avastin, qui agite l’ophtalmologie et l’Assurance maladie depuis plus de 2 ans. La situation paraissait claire.
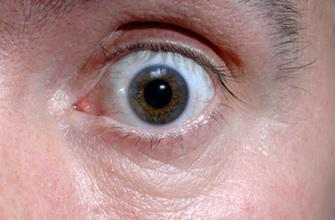
Face à la forme la plus agressive de la dégénérescence maculaire liée à l’âge, une maladie qui se traduit par la formation d’un réseau de vaisseaux sanguins sous la rétine provoquant progressivement une tâche opaque dans le champ de vision, il existait 2 médicaments. L’officiel, le Lucentis, qui coûte plus de 1000 euros l’injection, intégralement prise en charge par l’Assurance maladie et l’officieux, l’Avastin, très employé dans le traitement des cancers et utilisé à l’hôpital par les ophtalmologues en raison de son coût 10 à 40 fois moindre.
En ces temps de rigueur, une telle possibilité d’économie multipliée par 200 000 malades recevant chacun en moyenne 5 injections par an a évidemment mobilisé les pouvoirs publics. Mais ni l’Agence nationale de sécurité du médicament ni le ministère de la Santé n’ont pu contraindre le laboratoire Roche, fabricant d’Avastin, à mettre au point une formulation ophtalmologique de son médicament et à demander pour celle-ci une autorisation de mise sur le marché.
Elles ont donc procédé de façon plus indirecte. Les pouvoirs publics et l’Assurance maladie ont financé en 2009 une étude comparative des 2 traitements. En attendant ses résultats, la Direction générale de la santé a rappelé les règles en juillet 2012 en interdisant l’usage hors AMM de l’Avastin à l’hôpital pour les patients atteints de DMLA. Et fin 2012, la ministre a fait évoluer la loi pour pouvoir autoriser la recommandation temporaire d’utilisation d’un médicament, même s’il existe déjà une alternative à condition que cela permette d'éviter des dépenses significatives à l'Assurance maladie.
Le problème, c’est que les résultats de l’étude GEFAL menée auprès de 600 patients français, dont les résultats viennent d’être présentés aux congrès américain et français d’ophtalmologie, ne sont pas tout à fait le plébiscite espéré en faveur de l’économique Avastin. « Au bout d’un an, sur le critère de l’acuité visuelle qui nous paraît le plus important pour le patient et qui était l’objet de notre étude, les 2 traitements ont la même efficacité », souligne le Pr Laurent Kodjikian, ophtalmologiste au CHU de Lyon et coordonnateur de l’étude. Mais quelques inquiétudes persistent sur les effets secondaires non oculaires, qui semblent un peu plus nombreux pour les patients ayant reçu de l’Avastin sans que l’on soit sûr que c’est vraiment le médicament qui est en cause.
Ecoutez le Pr Laurent Kodjikian, ophtalmologiste au CHU de Lyon et coordonnateur de l’étude GEFAL : « Un patient qui se fracture le col du fémur en sortant de l’hôpital, on le déclare comme un événement indésirable grave, même si cela n’a aucun lien avec le médicament reçu ».
Il y a un autre mais. Il semble que le Lucentis soit un peu plus efficace que l’Avastin sur des critères liés à l’anatomie de l’œil comme l’épaisseur de la rétine ou les fuites de fluide intrarétinien observées à l’angiographie. Or ce petit plus sur le plan anatomique au bout d’un an de traitement pourrait se traduire à long terme par un bénéfice pour le patient, sachant que la DMLA est une maladie évolutive.
Ecoutez le Pr Laurent Kodjikian : « On suppose que cette petite supériorité en terme d’efficacité anatomique pourrait être un plus mais impossible de conclure ».
Alors que faire ? Privilégier le principe de précaution en n’autorisant que le Lucentis même s’il est onéreux tant que les études ne sont pas plus précises sur les effets secondaires de l’Avastin ? Adopter une stratégie plus économique en autorisant l’Avastin assorti de mesures de pharmacovigilance strictes ? Les ophtalmos français, en congrès à Paris jusqu’au 14 mai, se gardent bien de prendre position, soulignant que la décision est bien plus politique que médicale. Une manière élégante de dire qu’ils n’aimeraient pas être à la place de Marisol Touraine.