Le cancer se défend du système immunitaire qui protège normalement l’organisme en perturbant le fonctionnement de ce dernier. Une des méthodes utilisée par les cellules cancéreuses est d’actionner le système PD-1/PD-L1 à la surface des globules blancs spécialisés, les lymphocytes T, pour les freiner et se camoufler en quelque sorte. C’est ce qui est actuellement utilisé par les immunothérapies anti-PD-1/PD-L1, immunothérapies qui sont en train de révolutionner le traitement de nombreux cancers.
Une autre méthode de freinage du système immunitaire par le cancer vient d’être découverte par une équipe de chercheurs belges de l’Université de Louvain. Ils ont élucidé la structure tridimensionnelle d'un assemblage de protéines à la surface des lymphocytes Tregs, des cellules de l’immunité qui sont normalement chargées de freiner les réponses immunitaires. Ils ont également découvert comment un anticorps pourrait bloquer au mieux cet assemblage et l'immunosuppression qu'il induit. Un tel anticorps pourrait servir à stimuler l'immunité contre les cellules tumorales chez les patients cancéreux. L'étude est publiée dans la revue Science.
Immunosuppression et cascade d'interactions
Parmi les globules blancs, les lymphocytes Tregs (lymphocytes T régulateurs) sont des cellules immunosuppressives qui contrebalancent normalement des réactions immunitaires excessives, ceci afin de prévenir l’apparition des maladies auto-immunes. Mais chez les cancéreux, ils jouent un rôle délétère en modérant les réactions immunitaires contre les cellules tumorales.
Les lymphocytes Tregs induisent leurs effets en produisant une protéine-messager, appelée TGF-bêta. Ce messager transmet des signaux inhibiteurs aux cellules immunitaires situées à proximité, notamment à celles qui sont supposées détruire les tumeurs chez les patients cancéreux.
Bloquer la libération de TGF-bêta
La façon dont les lymphocytes Tregs produisent du TGF-bêta est complexe et régulée avec précision, car il est très puissant et il doit être gardé sous contrôle strict. Il y a trois ans, le professeur Sophie Lucas et son équipe de l’université de Louvain ont découvert que le TGF-bêta est libéré par les lymphocytes Tregs à partir d'une protéine appelée GARP, présente à la surface des Tregs. Son équipe a également découvert qu'il était possible de bloquer la libération de TGF-bêta par GARP grâce à des anticorps spécifiques, mais il fallait trouver les plus efficaces.
Les mécanismes moléculaires élucidés
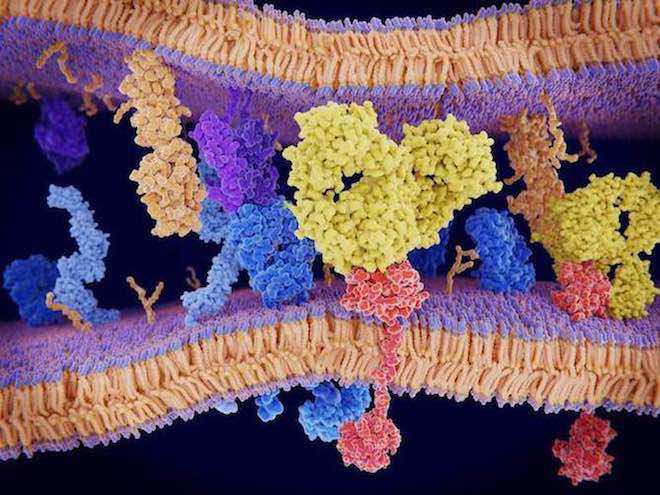
Les chercheurs ont utilisé la cristallographie aux rayons X pour étudier la structure tridimensionnelle des molécules GARP et TGF-bêta, lorsqu’elles produisent leurs effets inhibiteurs. Ils se sont alors aperçus que le GARP ressemblait à un fer à cheval chevauché par le TGF-bêta. Les deux molécules sont si étroitement assemblées que le TGF-bêta contribue lui-même à la structure de fer à cheval du GARP. Si l’on met un anticorps spécifique, celui-ci va coller les deux molécules l'une à l'autre, tout en bloquant la petite partie active de TGF-bêta qui ne sera pas alors libérée, et sera donc empêchée de transmettre son message inhibiteur aux autres cellules immunitaires.
La visualisation de ce grand assemblage moléculaire est une étape clé de la faisabilité du blocage de l’activité du TGF-bêta émanant des lymphocytes Tregs. Cette percée débouche sur des approches extrêmement spécifiques pour traiter diverses maladies associées à une activité altérée du TGF-bêta ou du lymphocyte Treg, notamment pour l'immunothérapie du cancer.