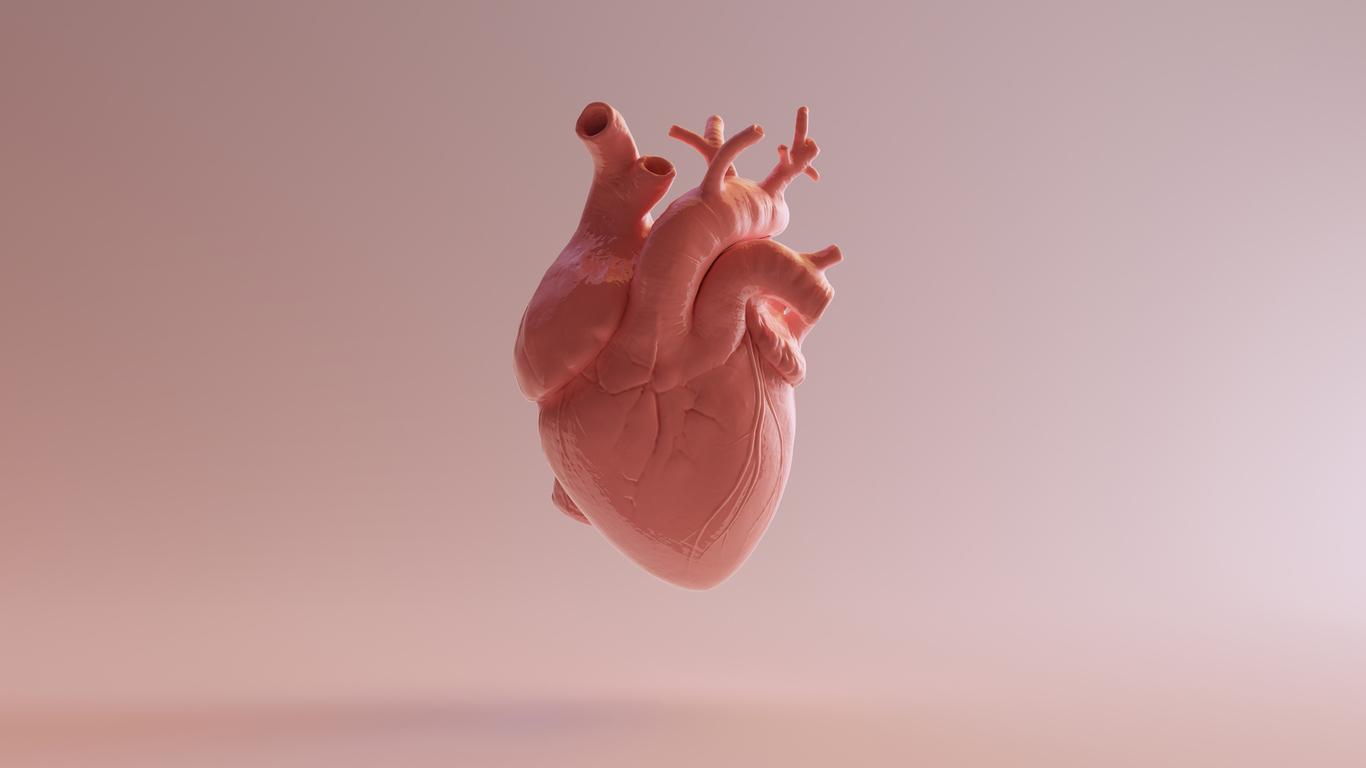
C’est une nouvelle étape dans l’histoire de Carmat. Cette entreprise française a développé un coeur artificiel, destiné aux personnes souffrant d’insuffisance cardiaque terminale. La FDA (Food and Drug Administration), la haute autorité de santé américaine, vient d’approuver le lancement d’un essai clinique dit “de faisabilité” aux Etats-Unis. Cette étude portera sur 10 patients éligibles, qui subiront une transplantation cardiaque dans sept centres cliniques du pays. Le critère principal d’évaluation sera la survie du patient dans les 180 jours suivant l’implantation, soit six mois. Un point d’étape à 60 jours est prévu pour les trois premiers patients, avant le recrutement des sept autres. Dans un communiqué, le directeur général de Carmat, Stéphane Piat, se félicite de cette nouvelle. “Compte tenu des procédures d’approbation en cours avec les comités éthiques des centres sélectionnés et des discussions sur le remboursement éventuel des coûts de traitement, nous anticipons le début du recrutement des patients au 4e trimestre 2020”, précise-t-il.
Un essai clinique suspendu
Cette décision est une victoire pour Stéphane Piat, engagé dans un bras de fer avec les autorités sanitaires françaises depuis des années. En effet, en 2016, l’ANSM (Agence nationale de sécurité du médicament et des produits de santé) a suspendu l’essai clinique après le décès du cinquième patient greffé dans l’Hexagone. C’est à ce moment que Carmat a sérieusement envisagé de délocaliser ses essais à l’étranger, notamment aux Etats-Unis. Après avoir prouvé que le décès de ce patient était lié à une mauvaise manipulation des batteries par le malade lui-même et non pas à un dysfonctionnement de la prothèse, Carmat est autorisé à reprendre ses essais cliniques en 2017. Depuis, l’entreprise se fait discrète sur les nouvelles transplantations. Nous savons que certaines ont été réalisées au Kazakhstan ou en République Tchèque, sans plus de détails.
Les réglementations françaises en cause ?
L’entreprise assure que la première transplantation réalisée à l’étranger, au Kazakhstan, “a été effectuée […] dans le respect du protocole de l’étude PIVOT approuvé par l’ANSM et conformément aux autorisations locales.” Si le choix de ce pays reste mystérieux, l’entreprise a affiché son choix d’étendre ses transplantations dans d’autres pays d’Europe afin d’obtenir le marquage CE, qui permet de vendre un produit dans les 27 Etats membres ainsi qu’en Islande, Norvège et au Liechtenstein. Toutefois, la France a ses propres réglementations, au-delà des règles européennes. Ainsi, l’ANSM applique le principe de précaution. “Ce principe est dépassé dans beaucoup de pays où l’on parle plutôt de bénéfice/risque”, expliquait ainsi Stéphane Piat début 2017 dans les colonnes du Parisien, ajoutant que les Américains “sont plus souples et plus pragmatiques”. Avec le lancement de ce prochain essai clinique aux Etats-Unis, Carmat pourrait ainsi accéder au florissant marché américain.