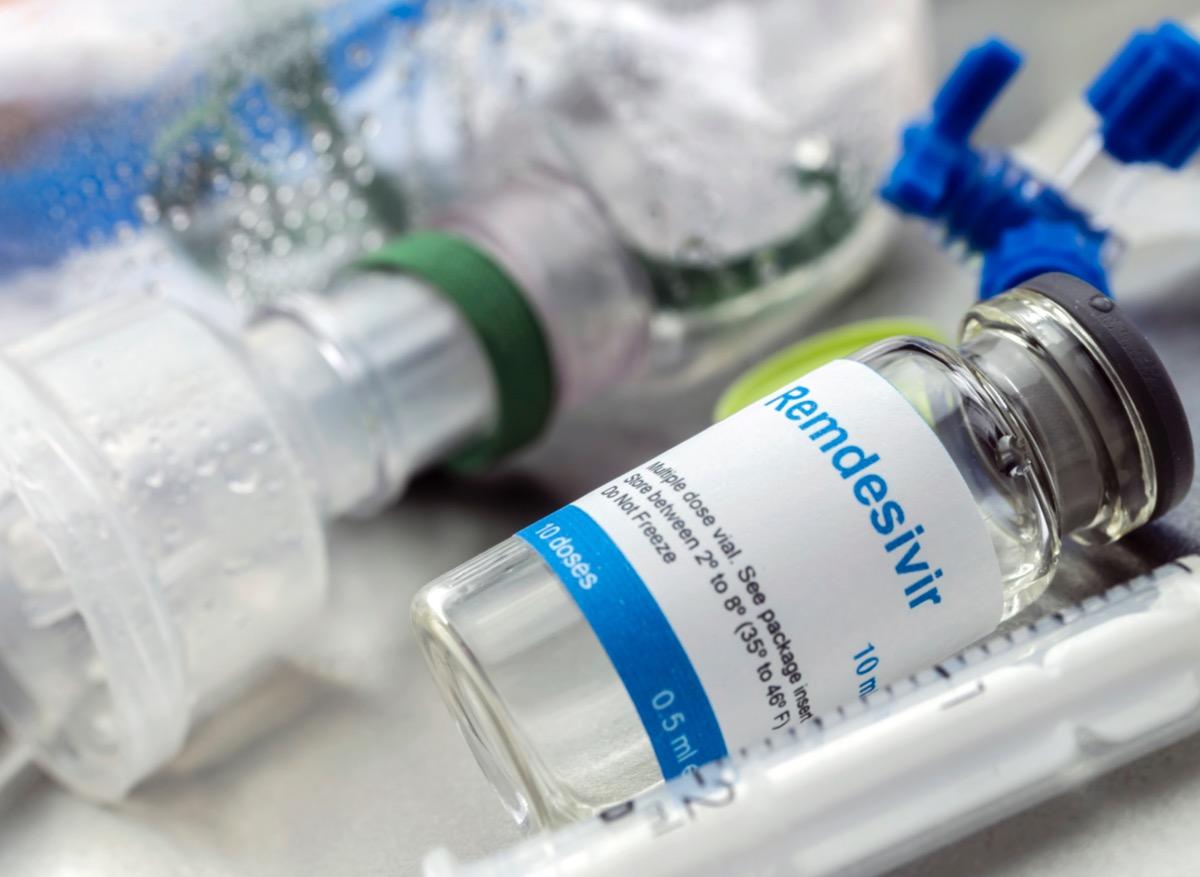
L’évaluation du remdésivir a démarré, a annoncé l’Agence européenne du médicament (AEM) dans un communiqué, lundi 8 juin. L’organisme a reçu une demande d’autorisation de mise sur le marché conditionnelle. La procédure sera accélérée et une décision devrait être rendue publique dans les prochaines semaines, si les données fournies sont suffisantes.
Un médicament autorisé dans plusieurs pays
Le remdésivir est un médicament initialement développé pour lutter contre le virus Ebola. Cet antiviral est un inhibiteur de l’ARN polymérase, c’est-à-dire qu’il bloque la production du matériel génétique du virus, ce qui l'empêche de se multiplier dans l’organisme.
Aux États-Unis, son utilisation dans le cas de la Covid-19 a été autorisée en mai par l’Agence américaine du médicament (FDA). “Il est raisonnable de penser que le remdésivir puisse être efficace contre le Covid-19 et que, étant donné qu'il n'existe pas de traitements alternatifs adéquats, approuvés ou disponibles, les avantages connus et potentiels pour traiter ce virus sévère et mortel sont supérieurs aux risques connus et potentiels posés par l'utilisation du médicament”, avait alors déclaré l’administration. D'autres pays autorisent également son usage, dont le Japon, l'Inde et la Corée du Sud.
Des essais contradictoires
Un essai américain, mené sur plus de 1 000 patients, a montré que le traitement du laboratoire Gilead permet de réduire de 31 % la durée de rétablissement des patients atteints d’une forme grave de la maladie. Leur survie était également plus importante. Dans une autre recherche, réalisée en Chine, des scientifiques ont réalisé un essai sur 237 patients, soit un échantillon beaucoup plus réduit : ils n’ont constaté aucune amélioration liée à l’administration de remdésivir. Une troisième étude parue dans The New England Journal of Medicine a confirmé l’intérêt du médicament, il a permis aux malades de guérir plus vite, lorsqu'ils n’étaient pas placés sous respirateur artificiel.
Une autorisation du Haut Conseil de la santé publique
Le médicament fait aussi partie de l’étude européenne Discovery. Cette dernière a démarré au mois de mars et vise à analyser l’efficacité de 4 médicaments dans le traitement de la Covid-19. Ses résultats pourraient permettre de préciser les effets du remdésivir.
En France, le Haut Conseil de la santé publique a déclaré, en mars, qu’il pouvait être utilisé dans les cas les plus sévères et en tenant compte de “l’état très limité des connaissances actuelles”. Il précise d’ailleurs que le praticien engage sa responsabilité dans la mesure où la prescription se fait en l’absence d’autorisation de mise sur le marché et hors essai clinique. La décision d'administration doit être prise de manière collégiale. Le traitement avait notamment été utilisé en janvier pour l’un des premiers patients hospitalisés atteints du nouveau coronavirus.