La Commission de Transparence de la HAS (Haute Autorité de Santé) a réévalué trois nouveaux anticoagulants oraux (NACO). Selon son analyse, ces nouveaux anticoagulants font preuve d’une efficacité variable, particulièrement lorsqu’ils sont prescrits dans la prévention des accidents vasculaires cérébraux et des embolies, chez les patients souffrant de fibrillation atriale non valvulaire.
L’apixaban (Eliquis®), le dabigatran (Pradaxa®) et le rivaroxaban (Xarelto®) sont arrivés sur le marché en 2008, explique la HAS dans un communiqué. Lors de leur évaluation initiale, la HAS avait considéré qu’ils rendaient tous un service médical important. Saisie par le Ministère de la Santé, la HAS a dû se prononcer à nouveau.
Une différence de bénéfices
L’analyse de la Commission de la Transparence a conduit à une différentiation entre les médicaments. Ainsi, le service médical rendu est considéré comme « important » pour Eliquis® et Xarelto®. En revanche, il est n'est que « modéré » pour Pradaxa®.
La HAS se montre favorable au maintien des trois molécules sur la liste des spécialités remboursables. Cependant un service médical rendu modéré entraine le plus souvent une réévaluation du taux de remboursement, qui passerait pour le Pradaxa à 30%, au lieu des 65 %.
Antivitamines K en première intention
Plus globalement, la HAS était invitée à se prononcer sur la place de ces médicaments dans la stratégie de prévention des AVC et des embolies. Or, la Commission estime qu’en l’état actuel des connaissances, ils doivent être prescrits en deuxième intention, notamment en raison de l’absence actuelle d’antidote; des molécules sont en cours de développement. Les antivitamines K (AVK) doivent être prescrites en première intention.
Selon la HAS, les NACO sont à réserver à deux situations. D’une part, ils s’adressent aux patients sous AVK pour lesquels le maintien de l’INR (International Normalized Ratio) désiré dans la zone cible n’est pas assuré, et ce, malgré une observance correcte. D’autre part, ils sont à prescrire aux patients pour lesquels les AVK sont contre-indiqués ou mal tolérés.
« La HAS actualisera et diffusera à l’attention des prescripteurs une fiche de bon usage de ces médicaments », concluent les auteurs du communiqué. De son côté, l’Agence Nationale de sécurité du médicament (ANSM) a mis au point, dans son dernier bulletin « Vigilances », des tableaux à destination des professionnels de santé pour les aider à prescrire ces molécules.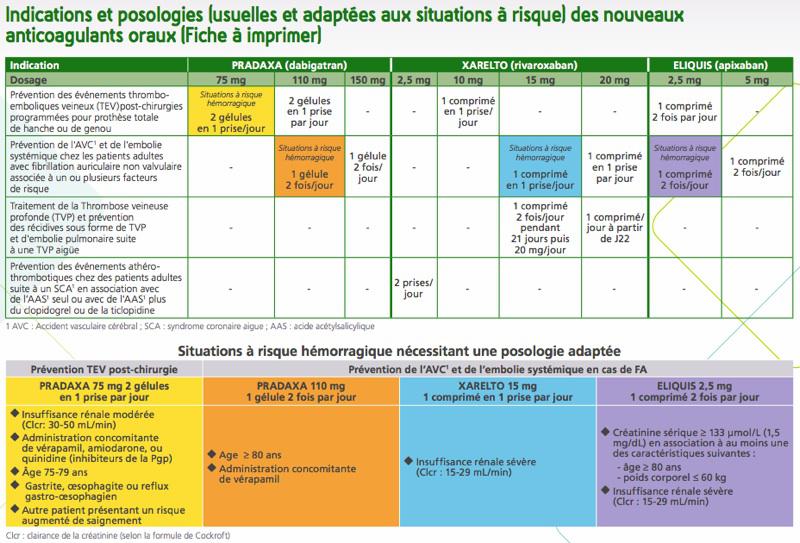
Le labo réagit
La réaction de Boehringer Ingelheim, fabricant du Pradaxa®, ne s'est pas faite attendre. Le laboratoire « ne comprend ni ne partage l’évaluation défavorable de la Commission », peut-on lire dans un communiqué de presse. Le laboratoire fulmine : « L’expérience de Pradaxa® représente plus de 3,5 millions de patients-années dans toutes ses indications autorisées à travers le monde depuis sa mise à disposition des prescripteurs il y a plus de 7 ans ». Boehringer Ingelheim se dit « confiant dans l’efficacité » de son médicament.
La firme pharmaceutique souligne par ailleurs se réserver le droit « d’utiliser tous les recours légaux pour faire appel des conséquences de cet avis concernant le remboursement » du médicament. A suivre…