Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Poudre (Composition pour 1 mL de suspension reconstituée)
Poudre (Composition pour 1 mL de suspension reconstituée)
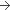 25 mg
25 mg
Pas de SMR disponible pour ce médicament
Pas d'ASMR disponible pour ce médicament