Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Poudre (Composition pour 1 mL de suspension reconstituée)
Poudre (Composition pour 1 mL de suspension reconstituée)
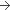 25 mg
25 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 08/07/2020 | Inscription (CT) | Le service médical rendu par AZACITIDINE BETAPHARM 25 mg/mL, poudre pour suspension injectable est important dans le traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant : un syndrome myélodysplasique (SMD) de risque intermédiaire 2 ou élevé selon lindex pronostique international (International Prognostic Scoring System, IPSS), une leucémie myélomonocytaire chronique (LMMC) avec 10 à 29 % de blastes médullaires sans syndrome myéloprolifératif, une leucémie aiguë myéloblastique (LAM) avec 20 à 30 % de blastes et dysplasie de lignées multiples, selon la classification de lOrganisation Mondiale de la Santé (OMS). |
| Insuffisant | Avis du 08/07/2020 | Inscription (CT) | Le service médical rendu par AZACITIDINE BETAPHARM 25 mg/mL, poudre pour suspension injectable est et insuffisant dans le traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant une LAM avec > 30 % de blastes médullaires selon la classification de lOMS. |
| Important | Avis du 08/07/2020 | Inscription (CT) | Le service médical rendu par AZACITIDINE BETAPHARM 25 mg/mL, poudre pour suspension injectable est important dans le traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant : un syndrome myélodysplasique (SMD) de risque intermédiaire 2 ou élevé selon lindex pronostique international (International Prognostic Scoring System, IPSS), une leucémie myélomonocytaire chronique (LMMC) avec 10 à 29 % de blastes médullaires sans syndrome myéloprolifératif, une leucémie aiguë myéloblastique (LAM) avec 20 à 30 % de blastes et dysplasie de lignées multiples, selon la classification de lOrganisation Mondiale de la Santé (OMS). |
| Insuffisant | Avis du 08/07/2020 | Inscription (CT) | Le service médical rendu par AZACITIDINE BETAPHARM 25 mg/mL, poudre pour suspension injectable est et insuffisant dans le traitement des patients adultes non éligibles pour une greffe de cellules souches hématopoïétiques (GCSH) et présentant une LAM avec > 30 % de blastes médullaires selon la classification de lOMS. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 08/07/2020 | Inscription (CT) | Cette spécialité est un générique qui napporte pas damélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence VIDAZA 25 mg/mL (azacitidine), poudre pour suspension injectable, déjà inscrite. |
| V (Inexistant) | Avis du 08/07/2020 | Inscription (CT) | Cette spécialité est un générique qui napporte pas damélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence VIDAZA 25 mg/mL (azacitidine), poudre pour suspension injectable, déjà inscrite. |