Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour Une seringue préremplie)
Solution (Composition pour Une seringue préremplie)
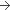 25 mg
25 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 14/12/2022 | Inscription (CT) | Le service médical rendu par AMVUTTRA (vutrisiran) est important dans lindication de lAMM. |
| Important | Avis du 14/12/2022 | Inscription (CT) | Le service médical rendu par AMVUTTRA (vutrisiran) est important dans lindication de lAMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 14/12/2022 | Inscription (CT) | Compte tenu : de la démonstration de la supériorité du vutrisiran versus un groupe placebo externe issu de létude APOLLO (étude pivot du patisiran) en termes damélioration du score mNIS+7, ainsi que sur des critères de jugement secondaires hiérarchisés, dans une étude de phase III, HE-LIOS-A, réalisée en ouvert, des différences relevées concernant certaines caractéristiques des patients entre les groupes vutrisiran et placebo externe et de labsence de randomisation entre ces 2 groupes ne permet-tant pas dassurer la comparabilité des groupes, de la démonstration de la non-infériorité du vutrisiran versus patisiran, uniquement sur un cri-tère de jugement secondaire hiérarchisé biologique, dans létude ouverte de phase III HELIOS-A, ne permettant pas de valoriser le vutrisiran par rapport au patisiran, de la méthodologie de létude HELIOS-A qui apparait de ce fait peu robuste, ce qui atténue la portée de ses résultats, mais prenant en compte : ladministration du vutrisiran par |
| V (Inexistant) | Avis du 14/12/2022 | Inscription (CT) | Compte tenu : de la démonstration de la supériorité du vutrisiran versus un groupe placebo externe issu de létude APOLLO (étude pivot du patisiran) en termes damélioration du score mNIS+7, ainsi que sur des critères de jugement secondaires hiérarchisés, dans une étude de phase III, HE-LIOS-A, réalisée en ouvert, des différences relevées concernant certaines caractéristiques des patients entre les groupes vutrisiran et placebo externe et de labsence de randomisation entre ces 2 groupes ne permet-tant pas dassurer la comparabilité des groupes, de la démonstration de la non-infériorité du vutrisiran versus patisiran, uniquement sur un cri-tère de jugement secondaire hiérarchisé biologique, dans létude ouverte de phase III HELIOS-A, ne permettant pas de valoriser le vutrisiran par rapport au patisiran, de la méthodologie de létude HELIOS-A qui apparait de ce fait peu robuste, ce qui atténue la portée de ses résultats, mais prenant en compte : ladministration du vutrisiran par |