Depuis sa mise sur le marché, le valproate de sodium a provoqué 2 150 à 4 100 malformations congénitales graves, selon l’Agence nationale de sécurité du médicament (ANSM). Dépakine, Dépakote et leurs génériques ont beau être interdits chez la femme enceinte, les expositions restent trop fréquentes. L’impact de ce traitement, indiqué dans l’épilepsie et les troubles bipolaires, est pourtant connu.
Les fœtus exposés sont à haut risque de malformations congénitales graves. Pour la première fois, ce danger est chiffré officiellement. Les calculs livrent des résultats inquiétants et « confirment le caractère hautement tératogène du valproate », conclut l’ANSM.
Pour parvenir à ces chiffres, l’Agence s’est appuyée sur une base solide et fiable, qui court entre 2011 et 2015. 2 millions de femmes enceintes ont été suivies, à travers les données de l’Assurance maladie. Parmi elles, 2 300 ont reçu du valproate pendant leur grossesse.
Quatre fois plus de risque
Les bébés exposés in utero au médicament sont nettement défavorisés par rapport aux autres. Lorsque leur mère est traitée pour épilepsie, le risque qu’ils souffrent d’une malformation grave est quatre fois plus élevé. Pour les enfants dont la mère souffre de trouble bipolaire, cette probabilité est doublée. L’écart n’est pas dû au hasard : l’ANSM rappelle que les expositions sont plus faibles dans la deuxième indication, et les arrêts plus fréquents en cas de grossesse.
Dans le détail, certaines malformations sont particulièrement fréquentes en cas d’exposition au valproate. Le risque de spina bifida, une anomalie dans la fermeture du tube neural, est ainsi 18 fois plus élevé qu’en temps normal. De même, la probabilité que l’enfant développe une fente palatine ou un hypospadias (ouverture de l’urètre dans le côté inférieur du pénis) est cinq fois plus forte. Sans surprise, le risque augmente avec la dose.
75 000 bébés exposés
Entre 2011 et 2015, 43 cas de malformations congénitales sévères ont été signalés chez les enfants exposés au valproate. A partir de ce résultat, les experts de l’ANSM ont réalisé une projection sur l’ensemble de la période de commercialisation, entre 1967 et 2016. Dans le pire des scénarios, 75 300 bébés se sont développés alors que leur mère était traitée. 4 100 d’entre eux seraient nés avec une malformation grave. Dans la majorité des cas, le médicament était prescrit pour traiter une épilepsie.
Au vu de ces résultats, la suite de l’enquête menée par l’ANSM est attendue de pied ferme. Car les anomalies congénitales ne sont pas les seuls effets secondaires du valproate de sodium. La molécule est aussi à l’origine de troubles neuro-développementaux et de troubles du spectre autistique. Lors de la modification de l’autorisation du mise sur le marché du traitement, en 2006, ce risque était estimé à 30-40 %. Il est en cours d’évaluation et les conclusions devraient paraître au second semestre de cette année. Dans le même temps, l’Agence a lancé un travail de réévaluation des risques associés aux traitements antiépileptiques. Il serait « en cours de finalisation ».
Des conditions strictes de prescription
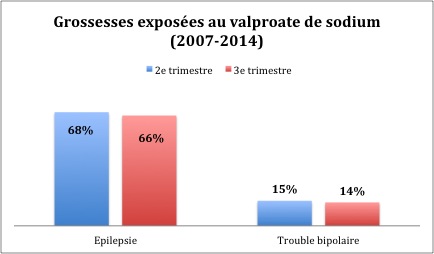
Le vaproate de sodium et ses dérivés sont autorisés dans deux indications en France : l’épilepsie partielle ou généralisée, et le trouble bipolaire. L’ANSM recommande officiellement de limiter les prescriptions. Sauf échec des autres traitements, les médecins sont invités à ne pas donner de valproate aux femmes et jeunes filles en âge de procréer, ainsi qu’aux femmes enceintes. En 2015, les conditions de prescription et de délivrance ont été restreintes. Seuls les spécialistes (neurologue, psychiatre, pédiatre) sont autorisés à établir une première ordonnance. La patiente doit signer un accord de soins et présenter un formulaire d’accord au pharmacien. Mais ces recommandations ne sont pas toujours respectées. Entre 2007 et 2014, plus de 14 000 grossesses ont été exposées au valproate.